- Trang chủ » Tin tức » Trở về với thiên nhiên
Trở về với thiên nhiên
Tóm tắt Dựa trên phân tích toàn bộ trình tự bộ gen, chủng mới FJAT-46737 được xác định là Bacillus velezensis và bảy cụm gen chịu trách nhiệm tổng hợp các chất chuyển hóa thứ cấp có hoạt tính sinh học trong FJAT-46737 đã được dự đoán. Kết quả kháng khuẩn đã chứng minh rằng FJAT-46737 thể hiện hoạt động kháng khuẩn phổ rộng trong ống nghiệm chống lại ba loại vi khuẩn và ba loại nấm. Các thí nghiệm trong chậu cho thấy hiệu quả kiểm soát bệnh héo vi khuẩn cà chua của toàn bộ môi trường nuôi cấy, chất nổi phía trên được pha loãng 2 lần và lipopeptide thô của FJAT-46737 lần lượt là 66,2%, 82,0% và 96,2%. Các kết quả trên cho thấy một trong những cơ chế đối kháng của FJAT-46737 là sự tiết ra lipopeptide bao gồm iturin, fengycins và Surfactin. Các lipopeptide thô có hoạt tính đối kháng đáng kể chống lại một số mầm bệnh (bao gồm Ralstonia solanacearum, Escherichia coli và Fusarium oxysporum) và fengycin là thành phần kháng khuẩn chính của lipopeptide chống lại R. solanacearum trong ống nghiệm. Hơn nữa, nguồn nitơ hữu cơ phong phú (đặc biệt là chiết xuất nấm men) trong môi trường đã thúc đẩy FJAT-46737 sản xuất fengycin và Surfactin. Sự tiết ra hai lipopeptide này có liên quan đến sự dao động nhiệt độ, với hàm lượng fengycin giảm 96,6% và hàm lượng Surfactin tăng 59,9% từ 20 °C đến 40 °C. Nhiệt độ tối ưu để sản xuất lipopeptide bằng FJAT-46737 dao động trong khoảng từ 20 °C đến 25 °C.
Bệnh héo vi khuẩn do Ralstonia solanacearum gây ra là một căn bệnh tàn khốc ảnh hưởng đến gần 250 loài thực vật và đe dọa nghiêm trọng đến sự phát triển của thực vật và dẫn đến thiệt hại lớn trên toàn thế giới [1, 2]. Các biện pháp nông nghiệp truyền thống như luân canh, vệ sinh đồng ruộng, canh tác giống kháng và sử dụng thuốc diệt khuẩn bằng hóa chất đã được áp dụng rộng rãi để kiểm soát bệnh héo vi khuẩn, mặc dù chúng có một số hạn chế nhất định [3]. Việc sử dụng lâu dài hoặc quá mức các chất diệt khuẩn hóa học gây ra tình trạng kháng thuốc của mầm bệnh và gây ảnh hưởng xấu đến môi trường, sinh vật có lợi và sức khỏe con người [3]. Việc xác định các phương pháp an toàn, hiệu quả và thay thế để kiểm soát bệnh mầm bệnh thực vật ngày càng trở nên quan trọng để nâng cao sản lượng và chất lượng nông sản. Hơn nữa, kiểm soát sinh học bằng cách sử dụng các vi sinh vật đối kháng bao gồm vi khuẩn, nấm men và nấm sợi là một phương pháp thay thế an toàn, hiệu quả và bền vững để chống lại mầm bệnh thực vật so với thuốc diệt khuẩn hóa học [4,5,6]. Các thành viên của chi Bacillus đã được sử dụng làm tác nhân kiểm soát sinh học hiệu quả để giảm thiệt hại do bệnh héo vi khuẩn gây ra và các sản phẩm có nguồn gốc từ chúng chiếm khoảng một nửa số thuốc trừ sâu sinh học có bán trên thị trường [7]. Tuy nhiên, việc kiểm soát bệnh héo vi khuẩn rất khó khăn và không hiệu quả do tính biến đổi di truyền cao, sự tồn tại lâu dài trong môi trường và phạm vi ký chủ rộng của R. solanacearum. Vì vậy, việc sử dụng các chất kháng khuẩn thay thế là cần thiết [3, 8]. Như vậy có thể kết luận chủng B. velezensis FJAT-46737 và các lipopeptide tiết ra của nó có thể được sử dụng làm nguồn tác nhân kiểm soát sinh học tiềm năng mới chống lại một số mầm bệnh thực vật và đặc biệt là mầm bệnh héo vi khuẩn R. solanacearum. Sơ lược Các nghiên cứu về cơ chế kiểm soát sinh học của tác nhân Bacillus chỉ ra rằng tác dụng kiểm soát sinh học của một số chủng chủ yếu liên quan đến việc chúng sản xuất các phân tử hoạt tính sinh học khác nhau [9]. Lipopeptide thuộc về các chất hoạt tính sinh học quan trọng nhất và chúng thể hiện các đặc tính tuyệt vời, như hoạt tính kháng sinh phổ rộng, ổn định tốt, độc tính thấp, khả năng phân hủy sinh học cao và giảm tính nhạy cảm với thuốc [10]. Các lipopeptide của Bacillus bao gồm ba loại, cụ thể là iturin (bacillomycin D/F/L/Lc, iturin A/C/D/E và mycosubtilin), fengycin (fengycin A/B, và plipastatin A/B) và Surfactin (halobacillin, pumilaxitin và Surfactin) [11,12,13].
Tất cả các lớp được đề cập đều có chung cấu trúc phân tử lưỡng tính bao gồm chuỗi bên axit béo liên kết với vòng peptide tuần hoàn (Hình S1).

Trong số đó, iturin có hoạt tính kháng nấm mạnh đối với nhiều loại nấm men và nấm sợi nhưng có hoạt tính kháng khuẩn hạn chế; các fengycin có hoạt tính kháng nấm mạnh, đặc biệt là trên nấm sợi, mặc dù khả năng ức chế vi khuẩn của chúng chỉ mới được báo cáo gần đây bởi Villegas-Escobar et al. [14]; và các chất hoạt động bề mặt thể hiện hoạt động diệt khuẩn hiệu quả và có thể làm giảm sức căng bề mặt của rễ cây, tạo điều kiện thuận lợi cho khả năng bơi lội và hình thành màng sinh học của các chủng Bacillus, từ đó cung cấp khả năng bảo vệ chống lại sự tấn công của mầm bệnh [15].
Các nghiên cứu về lipopeptide chủ yếu tập trung vào việc kiểm soát nấm gây bệnh thực vật, chẳng hạn như Rhizoctonia solani [16], Pythium ultimum [4], Botrytis cinerea [17], Podosphaera fusca [17], Fusarium graminearum [18, 19], Fusarium oxysporum [19], và Sclerotinia sclerotiorum [20]. Một số nghiên cứu tập trung vào mầm bệnh vi khuẩn R. solanacearum. Zhu và cộng sự. [21] đã báo cáo rằng hỗn hợp lipopeptide (surfactin và iturin A) do Bacillus amyloliquefaciens XX-173 tạo ra có thể ức chế hiệu quả sự phát triển của R. solanacearum. Hơn nữa, lipopeptide do Xperia Z173 tiết ra đã được sử dụng để sản xuất vật liệu tổng hợp lipopeptide-khoáng chất để đạt được hiệu quả kiểm soát sinh học 87,76% đối với bệnh héo vi khuẩn ở cà chua [22]. Lipopeptide ngăn chặn bệnh cây bằng cách cản trở trực tiếp mầm bệnh hoặc bằng cách thúc đẩy sức đề kháng toàn thân gây ra ở cây chủ [17, 23, 24]. Một mối tương quan mạnh mẽ đã được báo cáo giữa hoạt động tạo ra sự phòng vệ và hàm lượng Surfactin do các chủng Bacillus tạo ra [25]. Ngoài ra, người ta đã báo cáo rằng lipopeptide do vi khuẩn Bacillus tiết ra phụ thuộc vào chủng của nó, thành phần môi trường nuôi cấy và điều kiện nuôi cấy [26,27,28]. Nghiên cứu hiện tại báo cáo về chủng kiểm soát sinh học sản xuất lipopeptide mới FJAT-46737, được xác định thông qua phân tích toàn bộ trình tự bộ gen và các cụm gen chuyển hóa thứ cấp có hoạt tính sinh học trong chủng này đã được dự đoán. Tác dụng ức chế của FJAT-46737 và lipopeptide của nó đã được đánh giá in vitro và in vivo. Hơn nữa, các thành phần lipopeptide đã được xác định; và ảnh hưởng của điều kiện nuôi cấy đến hoạt tính kháng khuẩn của chủng và lipopeptide của nó đã được nghiên cứu. Công việc này có xu hướng thúc đẩy việc ứng dụng chủng FJAT-46737 và các lipopeptide của nó làm nguồn tác nhân kiểm soát sinh học mới chống lại mầm bệnh thực vật, đặc biệt là mầm bệnh héo vi khuẩn R. solanacearum.
Kết quả
Nhận dạng và hoạt động đối kháng của FJAT-46737 Chủng FJAT-46737 là vi khuẩn gram dương và hình thành nội bào tử. Các khuẩn lạc của nó trên tấm NA phẳng, hơi nhám, gần như tròn và có màu vàng nhạt (Hình S2).

Tác dụng kiểm soát sinh học của toàn bộ môi trường nuôi cấy FJAT-46737 (a), chất nổi phía trên môi trường nuôi cấy (b), lipopeptide thô 1 mg/mL (c) và kiểm soát (d) chống lại bệnh héo vi khuẩn. Lưu ý: a. kháng khuẩn b. thuốc chống nấm
Phân tích phát sinh gen của kết quả gen 16S rRNA và gyrB chỉ ra rằng chủng FJAT-46737 thuộc chi Bacillus và có liên quan chặt chẽ với các chủng B. velezensis và B. amyloliquefaciens (Hình S3, S4). Gen 16 S rRNA của FJAT-46737 thể hiện mức độ tương đồng lần lượt là 99,72, 99,71 và 99,44% với các chủng loại Bacillus siamensis KCTC 13613T, Bacillus velezensis CR-502T và B. amyloliquefaciens DSM7T. Gen gyr B của FJAT-46737 thể hiện sự giống nhau hơn 99,0% với các loài điển hình của B. amyloliquefaciens và B. velezensis. Do mức độ liên quan cao giữa B. amyloliquefaciens, B. siamensis và B. velezensis, nên phương pháp ANI dựa trên trình tự toàn bộ bộ gen đã được sử dụng để phân biệt chủng FJAT-46737. Trình tự toàn bộ bộ gen của chủng FJAT-46737 chứa 3.995.340 bp và hàm lượng G + C của DNA nhiễm sắc thể là 46,5%. Giá trị ANI giữa chủng FJAT-46737 và chủng loại B. amyloliquefaciens DSM7T, B. siamensis KCTC 13613T và B. velezensis KCTC 13012T được tính toán lần lượt là 94,16, 94,36 và 98,26%. Cái cuối cùng hiển thị giá trị ANI> 98%, vượt quá mức giới hạn được khuyến nghị là 96% để phân định loài. Kết quả này cho thấy chủng FJAT-46737 là thành viên của loài B. velezensis. Các cụm gen của chất chuyển hóa thứ cấp có hoạt tính sinh học ở chủng FJAT-46737 được phân tích bằng phương pháp antiSMASH. Kết quả cho thấy chủng FJAT-46737 sở hữu 7 cụm gen chịu trách nhiệm tổng hợp Surfactin, Fengycin, macrolactin, bacillaene, Difficidin, bacilysin và bacillibactin (Hình S5). Những phát hiện này chỉ ra rằng chủng FJAT-46737 có hoạt tính đối kháng mạnh mẽ. Phương pháp khuếch tán đĩa thạch được sử dụng để đánh giá hoạt động đối kháng của FJAT-46737 chống lại một số mầm bệnh ở động vật hoặc thực vật. Kết quả cho thấy chủng này có hoạt tính rõ rệt chống lại các vi khuẩn gram âm, bao gồm R. solanacearum và E. coli với đường kính vùng ức chế là 6,95–14,56 mm và nấm sợi, bao gồm 3 biotype là. oxysporum (F. oxysporum f. sp. Capsicum, F. oxysporum f. sp. niveum và F. oxysporum f. sp. melonis) (Hình 1) với tỷ lệ ức chế là 65,25%–72,71%.
Hiệu quả kiểm soát sinh học của FJAT-46737 đối với bệnh héo vi khuẩn cà chua Kết quả trên cho thấy chủng B. velezensis FJAT-46737 có hoạt tính kháng khuẩn in vitro đối với R. solanacearum. Vì vậy, chúng tôi đã cố gắng nghiên cứu hiệu quả kiểm soát sinh học của nó đối với bệnh héo vi khuẩn cà chua bằng cách thực hiện các thí nghiệm trong chậu trong điều kiện nhà kính. Đầu tiên, chúng tôi thấy rằng DI của cây cà chua trong nhóm xử lý với toàn bộ môi trường nuôi cấy FJAT-46737 (31,7%) thấp hơn nhiều so với nhóm đối chứng (93,8%) (Hình 2, Bảng 1). Hiệu quả kiểm soát sinh học của toàn bộ môi trường nuôi cấy FJAT-46737 chống lại bệnh héo vi khuẩn cà chua có thể đạt tới 66,2% trong các thí nghiệm trong nhà kính (Bảng 1).
Bảng 1 Hiệu quả kiểm soát sinh học và tỷ lệ mắc bệnh ở các nhóm cây trồng được xử lý khác nhau
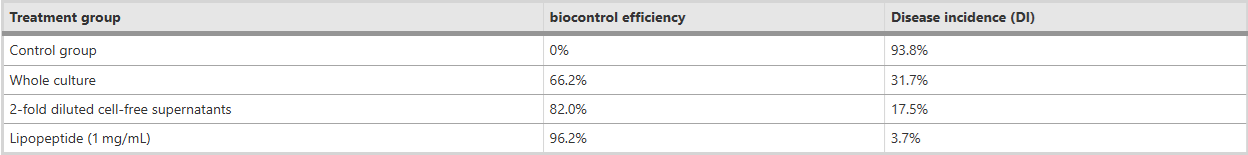
Để làm rõ các cơ chế kiểm soát sinh học của FJAT-46737, sau đó chúng tôi đã đánh giá tác động ức chế của chất nổi không có tế bào của nó đối với bệnh héo vi khuẩn ở cà chua. Một thí nghiệm sơ bộ chỉ ra rằng chất nổi phía trên không có tế bào không được pha loãng gây tổn thương cho cây con trong khi chất nổi phía trên được pha loãng 2 lần không có tác dụng gây tổn thương. Do đó, chất nổi phía trên không có tế bào được pha loãng gấp 2 lần đã được chọn để thực hiện các thí nghiệm trong chậu. Kết quả cho thấy hiệu quả kiểm soát sinh học khoảng 82,0% có thể đạt được ở nhóm xử lý bề mặt không có tế bào (Hình 2, Bảng 1), cho thấy khả năng kiểm soát sinh học của FJAT-46737 có thể chủ yếu (nếu không nói là hoàn toàn) do sản xuất các chất hoạt tính sinh học ngoại bào. Chúng tôi đã thử nghiệm thêm hiệu quả kiểm soát sinh học của chiết xuất lipopeptide thô từ FJAT-46737 chống lại nhiễm trùng rễ cà chua do R. solanacearum. Một thí nghiệm sơ bộ chỉ ra rằng nồng độ lipopeptide cao (>2,5 mg/mL) dẫn đến tổn thương cây con trong khi lipopeptide 1 mg/ml không gây tổn thương cho cây con. Do đó, nồng độ lipopeptide 1 mg/mL đã được chọn để thực hiện các thí nghiệm trong chậu. Việc xử lý cây con được ngâm bằng lipopeptide có thể làm giảm đáng kể tỷ lệ chết của cây cà chua và đạt được hiệu quả kiểm soát sinh học là 96,2% (Hình 2, Bảng 1). Những kết quả này cho thấy một trong những cơ chế đối kháng của chủng FJAT-46737 là sự tiết lipopeptide.
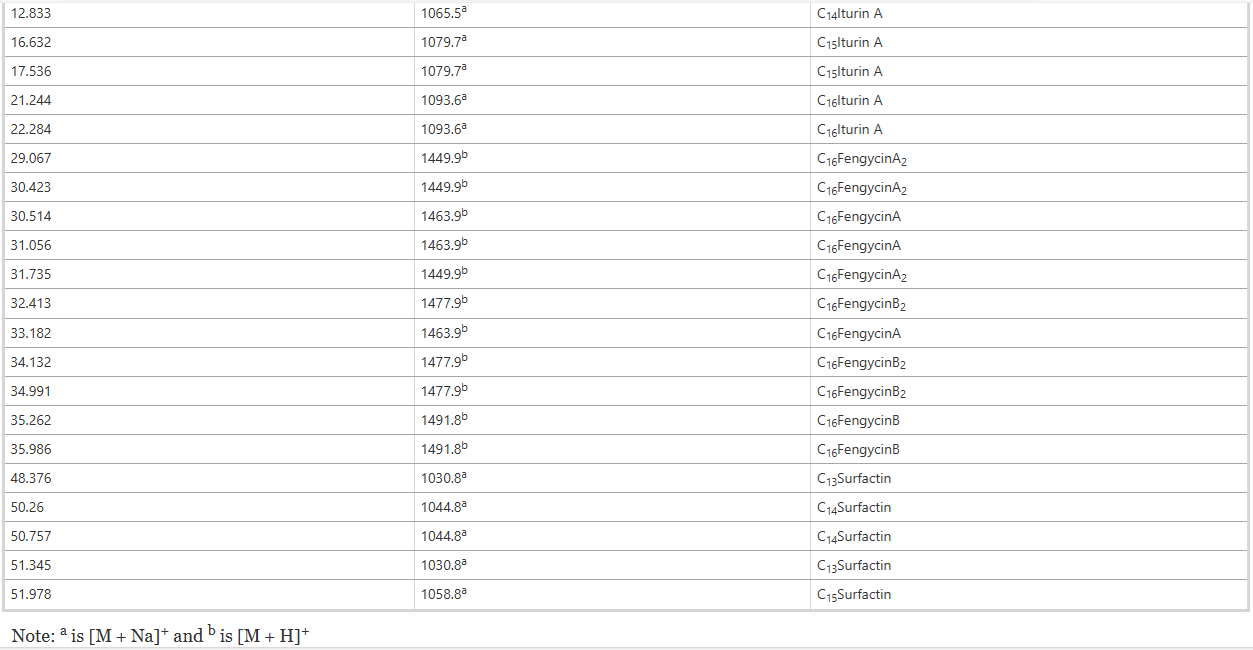
Phân tích LC-QTOF-MS/MS của lipopeptide được sản xuất bởi FJAT-46737 Trong nghiên cứu này, chúng tôi đã sử dụng phương pháp LC-ESI-MS/MS để xác định cấu hình lipopeptide của FJAT-46737. Ba loại lipopeptide tuần hoàn, đó là iturin (thời gian lưu, 12,8–22,3 phút), fengycin (29,0–36,0 phút) và Surfactin (48,3–52,0 phút), đã được phát hiện và thời gian lưu, dữ liệu quang phổ MS và MS2 và kết quả xác định các lipopeptide từ B. velezensis FJAT-46737 được tóm tắt trong Bảng 2. Kết quả cho thấy các lipopeptide bao gồm C14–C16 iturin A, C13–C15 chất hoạt động bề mặt và C16 fengycin A/B và C16 fengycin A2/B2
Bảng 2 Định danh lipopeptide chiết xuất từ chủng Bacillus velezensis FJAT-46737 thông qua LC-QTOF-MS/MS
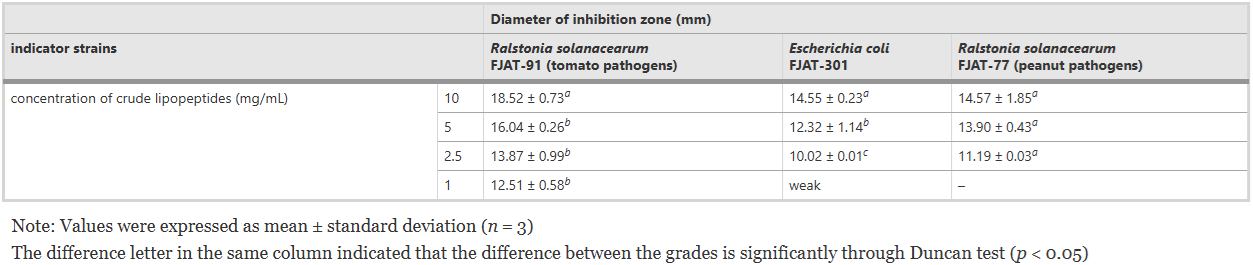
Phổ ức chế của lipopeptide đối kháng Chúng tôi đã sử dụng xét nghiệm khuếch tán giếng thạch để đánh giá thêm hoạt động kháng khuẩn của lipopeptide thô từ FJAT-46737. Kết quả cho thấy các lipopeptide thô có hoạt tính đáng kể chống lại R. solanacearum, E. coli và F. oxysporum theo cách phụ thuộc vào liều lượng (Bảng 3 và 4). Ở 48 giờ, đường kính vùng ức chế khi xử lý với 10 mg/mL lipopeptide thô có thể đạt tới 18,52 ± 0,73 mm, 14,55 ± 0,23 mm và 14,57 ± 1,85 mm đối với mầm bệnh R. solanacearum FJAT-91 và FJAT - 77 và E. coli FJAT-301 tương ứng (Bảng 3). Nồng độ lipopeptide 0,5 mg/mL cho thấy hoạt động kháng khuẩn chống lại R. solanacearum FJAT-91, trong khi nồng độ 0,25 mg/mL thì không (Hình S6). Những kết quả này ngụ ý rằng lipopeptide thô của FJAT-46737 có hoạt tính kháng khuẩn mạnh nhất đối với R. solanacearum. Hơn nữa, dưới 30 mg/mL lipopeptide thô, đường kính vùng ức chế đối với 4 kiểu sinh học của F. oxysporum (F. oxysporum f. sp. Capsicum FJAT-831, F. oxysporum f. sp. niveum FJAT-9230 và F. oxysporum f. melonis FJAT-30265) đều có kích thước xấp xỉ 20 mm ở thời điểm 72 h.
Bảng 3 Khả năng kháng khuẩn của lipopeptide từ chủng Bacillus velezensis FJAT-46747
Ảnh hưởng của thành phần môi trường và điều kiện nuôi cấy đến hoạt tính kháng khuẩn và hàm lượng lipopeptide Để cải thiện hơn nữa các hoạt động đối kháng của FJAT-46737, chúng tôi đã phân tích ảnh hưởng của các thành phần môi trường và nhiệt độ đến hoạt động kháng khuẩn của chất nổi trên bề mặt và lipopeptide thô. Cho rằng lipopeptide thô của FJAT-46737 có hoạt tính kháng khuẩn mạnh trên R. solanacearum, FJAT-91 được sử dụng làm vi khuẩn chỉ thị. Kết quả về hoạt tính đối kháng của hàm lượng lipopeptide thô và lipopeptide nổi trên bề mặt trong các điều kiện khác nhau được thể hiện trong Bảng 5 và 6.
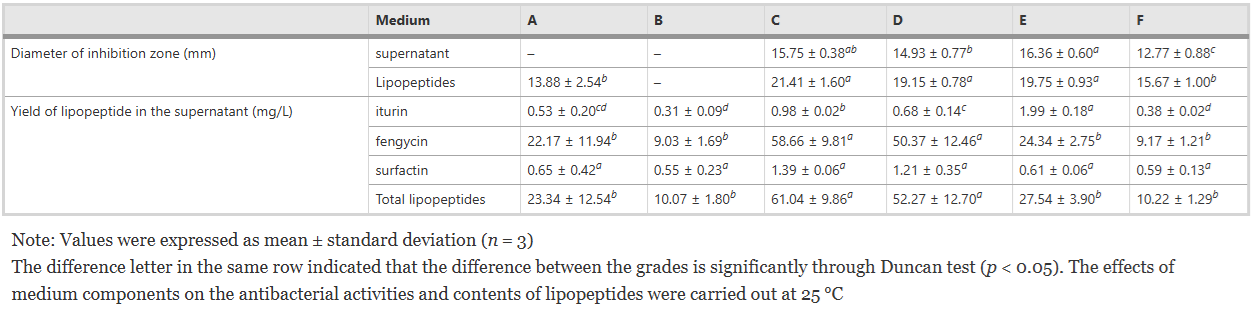
Bảng 5 Đường kính vùng ức chế của chất nổi trên bề mặt nuôi cấy và lipopeptide thô (10 mg/mL) được tạo ra bởi FJAT-46737 chống lại Ralstonia solanacearum FJAT-91 và hàm lượng lipopeptide trong môi trường nuôi cấy khác nhau
Bảng 6 Đường kính vùng ức chế chất nổi trên mặt nuôi cấy và lipopeptide thô (10 mg/mL) được tạo ra bởi FJAT-46737 chống lại Ralstonia solanacearum FJAT-91 và lipopeptide hàm lượng ở nhiệt độ thí nghiệm khác nhau
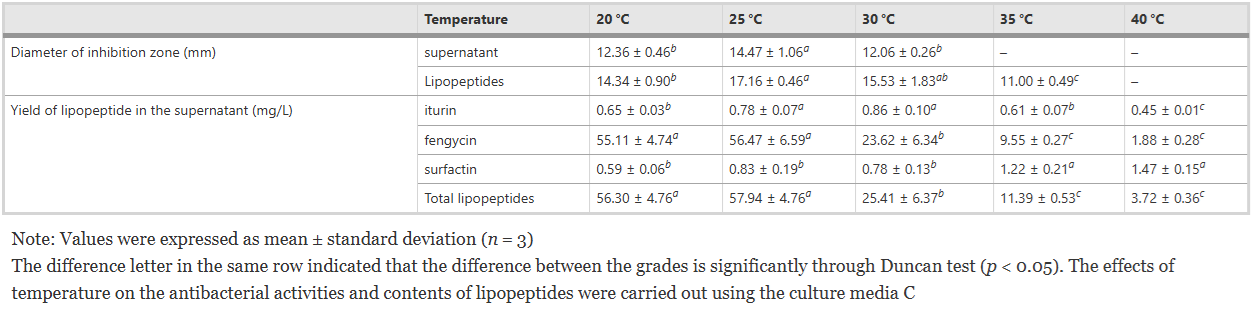
Sử dụng môi trường nuôi cấy đã chọn A ~ F (Bảng S1), chất nổi trên bề mặt và lipopeptide thô của FJAT-46737 thể hiện hoạt động kháng khuẩn tốt chống lại R. solanacearum FJAT-91, ngoại trừ chất nổi trên bề mặt nuôi cấy từ môi trường A (Bảng 5). Hơn nữa, hoạt tính kháng khuẩn của cả chất nổi trên bề mặt và lipopeptide thô từ môi trường nuôi cấy C, D và E đều mạnh hơn so với hoạt động kháng khuẩn của môi trường nuôi cấy A, B và F (Bảng 5). Những kết quả này cho thấy các thành phần môi trường có thể ảnh hưởng đáng kể đến hoạt động kháng khuẩn của FJAT-46737. Sau đó, ảnh hưởng của nhiệt độ đến hoạt động kháng khuẩn của chất nổi không có tế bào và lipopeptide thô được xác định bằng môi trường nuôi cấy C. Kết quả cho thấy nhiệt độ nuôi cấy có ảnh hưởng đáng kể đến hoạt động kháng khuẩn của chất nổi không có tế bào và lipopeptide thô : i) chất nổi phía trên không có tế bào không thể hiện hoạt tính kháng khuẩn khi nhiệt độ cao hơn 35 °C; và ii) cả chất nổi phía trên không có tế bào và lipopeptide thô đều có hoạt tính kháng khuẩn mạnh nhất khi ủ ở 25 °C (Bảng 6).
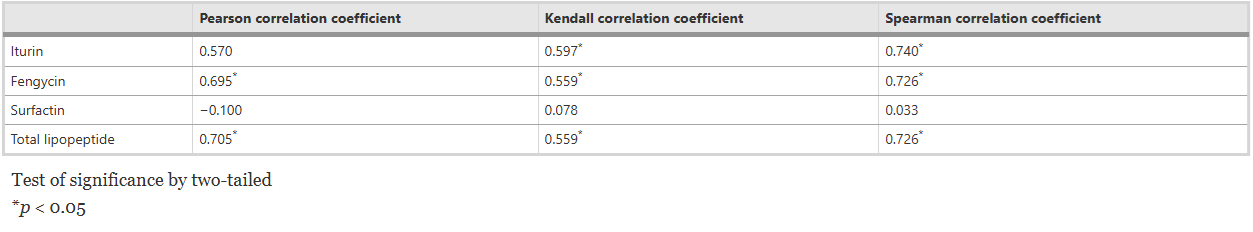
Hàm lượng iturin, fengycin và Surfactin trong các điều kiện nuôi cấy khác nhau được xác định thêm bằng LC-QTOF-MS và được tóm tắt trong Bảng 5 và 6. Fengycin là họ lipopeptide phong phú nhất được sản xuất bởi FJAT-46737. Hàm lượng iturin, fengycin và Surfactin trong sáu môi trường nuôi cấy thay đổi trong khoảng lần lượt là 0,31–1,99 mg/L, 9,03–58,66 mg/L và 0,55–1,39 mg/L. Hàm lượng lipopeptide trong môi trường nuôi cấy C và D cao hơn đáng kể so với bốn môi trường còn lại, cho thấy môi trường chứa nguồn nitơ hữu cơ giàu có thể có lợi cho việc sản xuất lipopeptide. Hơn nữa, việc bổ sung dịch chiết nấm men vào môi trường nuôi cấy D làm tăng đáng kể hiệu suất của lipopeptide so với việc thiếu dịch chiết nấm men (trong môi trường nuôi cấy B). Trong môi trường nuôi cấy C, hiệu suất sản xuất lipopeptide (61,04 ± 9,86 mg/L) là cao nhất so với các môi trường khác. Hơn nữa, hàm lượng iturin, fengycin và chất hoạt động bề mặt phụ thuộc rất nhiều vào nhiệt độ. Hàm lượng fengycin giảm 96,6% khi nhiệt độ nuôi cấy tăng từ 20°C lên 40°C trong khi hàm lượng Surfactin tăng 59,9%. Phạm vi nhiệt độ lần lượt là 25–30 °C, 20–25 °C và 35–40 °C phù hợp để sản xuất iturin, fengycin và Surfactin. Sau đó, một phân tích tương quan được thực hiện giữa hoạt tính kháng khuẩn bề mặt không có tế bào và hàm lượng lipopeptide trong các điều kiện nuôi cấy khác nhau (Bảng 7). Hàm lượng của fengycin và lipopeptide tổng số có mối tương quan đáng kể với hoạt động kháng khuẩn của chất nổi không có tế bào trong tất cả các mẫu (p < 0,05), trong khi hàm lượng của Surfactin và iturin không cho thấy mối tương quan này. Những kết quả này cho thấy hoạt động kháng khuẩn của chất nổi không có tế bào chủ yếu là do FJAT-46737 tiết ra fengycin.
Bảng 7 Hệ số tương quan giữa hoạt tính kháng khuẩn của dịch nổi nuôi cấy và hàm lượng lipopeptide
Tác dụng của lipopeptide tinh khiết trong việc ức chế sự phát triển của R. solanacearum Hoạt tính kháng khuẩn của lipopeptide tinh khiết chống lại R. solanacearum đã được thử nghiệm. Kết quả cho thấy chỉ có phần SPE thu được với 70% MeOH (tên là SPE70) có hoạt tính kháng khuẩn. Do đó, thành phần của phần SPE70 được xác định thêm bằng LC-QTOF-MS/MS (Hình S7). Kết quả cho thấy phân đoạn SPE70 chỉ chứa fengycin, chứng tỏ fengycin đóng vai trò quan trọng trong việc ức chế sự phát triển của R. solanacearum. Kết quả này phù hợp với phân tích tương quan ở trên.
Thảo luận Các phương pháp kiểu hình truyền thống và phân tích phát sinh gen được bảo tồn là không đủ để phân biệt các loài Bacillus, bao gồm B. subtilis, B. amyloliquefaciens, B. velezensis, B. siamensis, B. licheniformis và B. pumilus, do mối tương quan chặt chẽ giữa những loài này [29]. Tuy nhiên, sự sẵn có ngày càng tăng của trình tự bộ gen hoàn chỉnh đã tạo điều kiện thuận lợi cho việc phân biệt các loài này. Giá trị ANI dựa trên trình tự bộ gen hoàn chỉnh đã được tính toán và mức giới hạn 96% được đề xuất để phân định loài [29, 30]. Trong nghiên cứu hiện tại, chủng FJAT-46737 cho thấy độ tương tự 98,26% với chủng loại B. velezensis KCTC 13012T, cao hơn nhiều so với ngưỡng khuyến nghị là 96% để phân định loài. Do đó, FJAT-46737 được xác định là B. velezensis. Sự xuất hiện bệnh héo vi khuẩn ở cây trồng đã dẫn đến thiệt hại kinh tế lớn trên toàn thế giới. Hóa chất thường được sử dụng để kiểm soát bệnh cây trồng, mặc dù chúng có thể gây ô nhiễm môi trường và kháng lại mầm bệnh của vi sinh vật [3]. Nhiều nghiên cứu đã chỉ ra rằng việc sử dụng các chủng Bacillus làm tác nhân kiểm soát sinh học là một chiến lược đầy hứa hẹn và an toàn để quản lý bệnh héo vi khuẩn cà chua hiệu quả. Kwon và Kim đã báo cáo rằng B. subtilis JW-1 có thể làm giảm > 80% bệnh héo vi khuẩn và có thể được sử dụng như một tác nhân kiểm soát sinh học tiềm năng đối với bệnh héo vi khuẩn cà chua [31]. Xiong và cộng sự. đã phân lập chủng B. amyloliquefaciens JK6 và nhận thấy rằng nó có thể ức chế hiệu quả bệnh héo vi khuẩn cà chua với hiệu quả kiểm soát sinh học lên tới 52,9% trong hai điều kiện nhà kính [32]. B. subtilis 916 thể hiện hiệu quả kiểm soát sinh học 55,6% đối với bệnh héo vi khuẩn cà chua [33]. Trong nghiên cứu hiện tại, chúng tôi đã xác định được chủng kiểm soát sinh học mới B. velezensis FJAT-46737 và nó thể hiện hoạt động kháng khuẩn phổ rộng chống lại vi khuẩn gram âm và nấm sợi. Hiệu quả kiểm soát sinh học của chủng FJAT-46737 chống lại bệnh héo vi khuẩn cà chua là 66,2%, cao hơn so với nhiều loài Bacillus spp đã được báo cáo trước đây. như chủng APF1 (60,3%) [34], JK6 (58,6%) [32] và 916 (55,6%) [33].
Khả năng kiểm soát sinh học của các chủng Bacillus chống lại mầm bệnh thực vật đã được xác nhận là đạt được bằng cách tạo ra sức đề kháng của hệ thống vật chủ, sản xuất kháng sinh, bài tiết siderophore và lytic, hình thành màng sinh học hoặc cạnh tranh trong các hốc trong vùng rễ [35]. Bais và cộng sự. báo cáo rằng B. subtilis 6051 có thể kiểm soát nhiễm trùng rễ Pseudomonas syringae ở cây Arabidopsis nhờ sự tiết ra Surfactin và hình thành màng sinh học trên rễ cây [15]. Kwon và Kim đã chứng minh rằng B. subtilis JW-1 gây ra tác dụng ức chế bệnh héo vi khuẩn đáng kể trong cơ thể do sản xuất các lipopeptide tuần hoàn [31]. Xiong và cộng sự. báo cáo rằng sự tiết ra Surfactin của chủng JK6 đóng vai trò quan trọng trong việc kiểm soát sinh học bệnh héo vi khuẩn cà chua [32]. Trong nghiên cứu này, hiệu quả kiểm soát sinh học của chất nổi không có tế bào chống lại bệnh héo vi khuẩn cà chua là 82,0% trong khi hiệu quả của lipopeptide đạt tới 96,2%, cho thấy một trong những cơ chế ức chế bệnh của B. velezensis FJAT-46737 là lipopeptide bài tiết. Việc sản xuất lipopeptide của các loài Bacillus dựa trên các chủng: một số chủng có thể cùng tạo ra hai hoặc ba loại lipopeptide, trong khi những chủng khác chỉ có thể tạo ra một loại [11,12,13]. B. licheniformis MB01 chỉ sản xuất Surfactin [12], B. subtilis K1 đồng sản xuất Surfactin và iturin, trong khi B. amyloliquefaciens SYBC H47 tạo ra ba loại lipopeptide là bacillomycin, fengycin và Surfactin [36]. Trong nghiên cứu hiện tại, chủng B. velezensis FJAT-46737 có thể đồng sản xuất ba loại lipopeptide: C14–C16 iturin A, C16 fengycin A/B, C16 fengycin A2/B2, cũng như C14–C15 Surfactin. Hơn nữa, năng suất của lipopeptide bị ảnh hưởng đáng kể bởi các thành phần môi trường (như nguồn carbon và nitơ, kim loại vi lượng, v.v.) và điều kiện nuôi cấy (như nhiệt độ nuôi cấy, thời gian ủ, tốc độ quay, v.v.) [37]. Trong nghiên cứu này, B. velezensis FJAT-46737 có thể tạo ra ba loại lipopeptide trong cả sáu môi trường nuôi cấy phổ biến (A ~ F). Tuy nhiên, hoạt tính kháng khuẩn của lipopeptide thô (10 mg/mL) được tạo ra từ môi trường nuôi cấy A, B hoặc F yếu hơn nhiều so với ba môi trường còn lại (C, D và E). Nguồn carbon được coi là yếu tố chính ảnh hưởng đến việc sản xuất lipopeptide. Ví dụ, Li và cộng sự. phát hiện ra rằng sự thay đổi nguồn carbon trong môi trường nuôi cấy đã thay đổi loại lipopeptide do B. licheniformis HSN221 tạo ra [38]. Tuy nhiên, các loại lipopeptide do FJAT-46737 tạo ra không bị thay đổi cho dù môi trường nuôi cấy có chứa glucose hay không. Hơn nữa, nguồn nitơ đã được báo cáo là đóng một vai trò quan trọng trong việc điều hòa tổng hợp chất hoạt động bề mặt sinh học [39].
Kết quả của chúng tôi cho thấy nguồn nitơ hữu cơ phong phú trong môi trường có lợi cho việc sản xuất fengycin và Surfactin. Hơn nữa, chiết xuất từ nấm men có ảnh hưởng lớn hơn đến việc sản xuất fengycin so với iturin và Surfactin, điều này có thể liên quan đến phản ứng kém nhạy cảm hơn của phức hợp enzyme đối với quá trình sinh tổng hợp fengycin với nguồn nitơ so với iturin và Surfactin [40]. Điều thú vị là, nhiệt độ nuôi cấy có tác dụng ngược lại đối với hàm lượng fengycin và chất hoạt động bề mặt do chủng FJAT-46737 tạo ra: khi nhiệt độ tăng, hàm lượng fengycin giảm trong khi hàm lượng chất hoạt động bề mặt tăng. Những kết quả này không phù hợp với báo cáo của Monteiro và cộng sự, người đã phát hiện ra rằng nhiệt độ thấp (15 °C) thích hợp để sản xuất chất hoạt động bề mặt và lượng fengycin không bị ảnh hưởng bởi sự thay đổi nhiệt độ [37]. Fengycin và Surfactin được tổng hợp phi ribosom lần lượt bởi các enzyme fengycin synthetase và Surfactin synthetase [41]. Thông thường, nhiệt độ tối ưu cho hoạt động của enzyme là 37°C, điều này có thể giải thích tại sao hàm lượng chất hoạt động bề mặt tăng lên cùng với sự gia tăng nhiệt độ nuôi cấy. Việc giảm fengycin dưới nhiệt độ cao có thể là do hoạt động của enzyme tổng hợp fengycin giảm. Nhìn chung, nhiệt độ thích hợp cho cây trồng phát triển trên đồng ruộng là 20 °C–30 °C. Kết quả của chúng tôi chỉ ra rằng 25°C là nhiệt độ thuận lợi để sản xuất lipopeptide tạo ra hoạt động kháng khuẩn mạnh nhất, ngụ ý rằng chủng FAJT-46737 và lipopeptide của nó có khả năng thích ứng hệ sinh thái tốt và có triển vọng ứng dụng nông nghiệp trong tương lai. Các nghiên cứu trước đây đã chứng minh rằng chất hoạt động bề mặt thể hiện hoạt động kháng khuẩn trong khi iturin thể hiện hoạt tính kháng nấm mạnh với hoạt tính kháng khuẩn hạn chế. Họ fengycin đã được coi là đặc hiệu chống lại nấm sợi, mặc dù có hai trường hợp được báo cáo gần đây bởi Villegas-Escobar et al. [14] và Chen và cộng sự, [42]
chỉ ra rằng fengycin thể hiện hoạt tính kháng khuẩn mạnh mẽ chống lại R. solanacearum trong ống nghiệm. Trong nghiên cứu hiện tại, phân tích tương quan giữa hoạt tính kháng khuẩn của chất nổi trên bề mặt không có tế bào và hàm lượng lipopeptide chỉ ra rằng hoạt động kháng khuẩn của chất nổi trên bề mặt không có tế bào có mối tương quan dương đáng kể với hàm lượng của fengycin. Phát hiện này phù hợp với một báo cáo cho thấy có mối quan hệ đáng kể giữa hoạt tính kháng khuẩn mạnh và việc sản xuất fengycin và Surfactin của các chủng Bacillus phân lập [43]. Ngoài ra, chỉ phần SPE70 tinh khiết thể hiện hoạt tính kháng khuẩn trong ống nghiệm và nó chỉ bao gồm fengycin, cho thấy hoạt tính kháng khuẩn của hỗn hợp lipopeptide có thể là do fengycin. Những kết quả này càng khẳng định hoạt tính kháng khuẩn của fengycin được báo cáo lần đầu tiên bởi Villegas-Escobar et al. [14] và Chen và cộng sự, [42].
Kết luận Chủng B. velezensis mới FJAT-46737 với hoạt tính kháng khuẩn phổ rộng đã được xác nhận là có hoạt tính kháng khuẩn mạnh chống lại mầm bệnh héo vi khuẩn R. solanacearum bằng cả thí nghiệm in vivo và in vitro. Hơn nữa, tác dụng ức chế của FJAT-46737 có liên quan đến việc tiết lipopeptide, đặc biệt là hàm lượng fengycin. Do đó, FJAT-46737 và các lipopeptide của nó có triển vọng ứng dụng tốt trong việc kiểm soát sinh học bệnh héo vi khuẩn.
Bình luận
Bài viết liên quan khác
SẢN PHẨM & KHÓA HỌC TIÊU BIỂU
-
Băng keo tháp ghép cây co giãn, tự dính, chống nước mưa & tự hủy
Băng keo tháp ghép cây - co giãn, tự dính, chống nước mưa & tự hủy
-
Gạo sạch Thạnh Hội
Được canh tác trong một vùng đất phù sa cù lao bằng phương pháp hoàn toàn tự nhiên, không phân thuốc hóa học và gần như ...
-
Xử lý ra hoa sầu riêng
Nội dung sách có 09 chương: giới thiệu về tình hình sản xuất, tiêu thụ, nguồn gốc và phân bố; giống; đặc điểm ra hoa, phát triển trái; dinh ...
-
Tháp trồng rau hữu cơ - Giải pháp 3 trong 1
Không chỉ là loại chậu trồng đơn giản, tiện lợi (lắp ráp) mà tháp trồng rau hữu cơ còn là giải pháp 3 trong 1 - vừa là hệ thống xử lý giác ...
-
Dụng cụ kiểm tra nhanh dư lượng thuốc BVTV trên rau củ quả
Dư lượng thuốc BVTV (thuốc trừ sâu, thuốc trừ bệnh hại dùng trong nông nghiệp) là một trong những vấn đề nhức nhối và ...
-
Combo dinh dưỡng chăm sóc hoa kiểng
Đối với các loại hoa trồng trong chậu tết thì thời gian sinh trưởng chỉ kéo dài hơn 2 tháng. Do đó, lượng dinh dưỡng đầy đủ và cân đối ngay ...
Tin tức nổi bật

Miền Tây sau một thập niên đi theo lúa ba vụ (kỳ 1): ‘Được mất’ chống lũ thâm canh lúa

Miền Tây sau một thập niên đi theo lúa ba vụ (kỳ cuối): Tìm giải pháp ‘chữa lành’ tự nhiên

Rốt ráo kiểm tra, xác minh sầu riêng nhiễm Cadimi
GIẢM ĐỘC TỐ CADMIUM DI ĐỘNG TRONG ĐẤT NÔNG NGHIỆP Ô NHIỄM BẰNG THAN SINH HỌC (PHỤ PHẨM CÂY LÚA) VÀ ĐÁ PERLITE
SỰ CÂN BẰNG GIỮA AXIT VÀ KIỀM TRONG CƠ THỂ

Hội thảo khoa học về máy lọc nước Ion Kiềm ETUGI khu vực miền Nam

Nóng: Jack Ma chính thức từ bỏ Alibaba, chấm dứt sự nghiệp, bỏ sang nước ngoài làm giáo sư đại học, chuyên giảng về nông nghiệp?

Nếu con người đặc biệt đến vậy, sao sợ bị A.I. thay thế?

Cánh đồnǥ hàng chục tỷ trồng sầu riêng hữu ᴄơ rộng 30ha của một ông nông Ԁân ɓìnһ Pһước, thiên hạ тгầᴍ trồ